Natalia Fagali, investigadora del grupo IMBioMat del Instituto de Investigaciones Fisicoquímicas Teóricas y Aplicadas (Inifta), perteneciente a la UNLP y al Conicet, explicó que "el hierro (Fe) en el cuerpo se degrada y, además, nuestro organismo ya lo tiene como uno de sus elementos esenciales. Recordemos que la hemoglobina lo necesita para poder transportar el oxígeno por el torrente sanguíneo a todas las células. Entonces, como nuestro cuerpo está preparado para utilizar ese hierro liberado desde un implante, además de transportarlo y almacenarlo, parece que la ecuación de la biocompatibilidad cierra sin deberle nada a nadie".
"Por este motivo, surge la idea de usar este metal, que es biocompatible y se degrada en contacto con los fluidos biológicos, para que, al finalizar su función, no sea necesaria una segunda cirugía para retirarlo y que desaparezca del organismo", sostuvo.
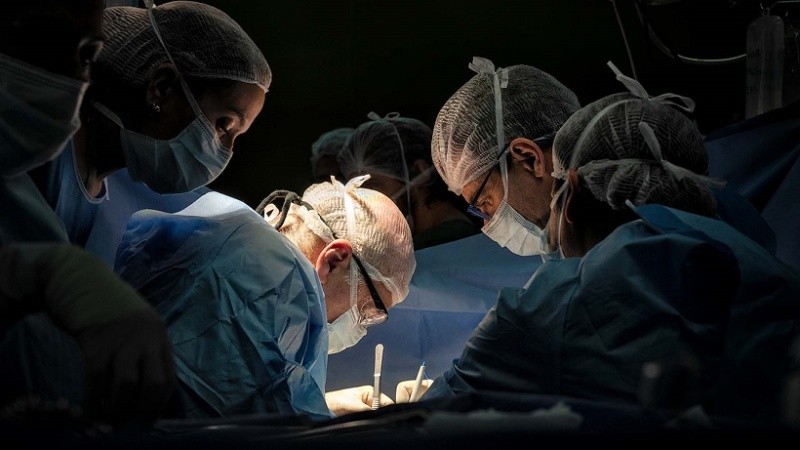
El problema que presenta el hierro cuando se lo utiliza como stent (malla que expande estructuras tubulares del cuerpo como vasos sanguíneos, esófago, uréter, etc) o en implantes ortopédicos, es que su velocidad de degradación es aún demasiado lenta y esto hace que se parezca más a los implantes permanentes, con sus complicaciones habituales, tales como retinosis, terapia antiplaquetaria extensa, rechazo, entre otros, que a un implante degradable.
"Los resultados de nuestros estudios preliminares nos permitieron confirmar que la presencia de magnesio induce una degradación más rápida del hierro, lo que hace que la velocidad de este proceso sea intermedia entre la del hierro y la del magnesio, además de tener una compatibilidad con cultivos celulares adecuada", agregó la investigadora.
Por otro lado, ensayos realizados con bacterias también demostraron que, gracias a la presencia de magnesio, los polvos al degradarse tienen efecto antimicrobiano, lo que resultaría una ventaja adicional teniendo en cuenta los numerosos casos de falla de implantes por infección que se contabilizan actualmente.
Los investigadores del Conicet también estudian cómo erradicar bacterias del organismo, y en ese sentido trabajan con nanopartículas.
"Las nanopartículas magnéticas de óxidos de hierro (SPIONs, de sus siglas en inglés) resultan útiles porque actúan directamente alterando o destruyendo físicamente la membrana de las bacterias, lo que minimiza la posibilidad de generar resistencia a las drogas. Por otro lado, pueden generar canales en el biofilm por acción de campos magnéticos externos y permitir el ingreso de antibióticos convencionales en tratamientos combinados", detalló.